양극 산화
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
양극 산화는 전기화학 전지를 이용하여 물질을 산화시키는 공정이다. 전극에 전압을 가하면 전극 표면 근처에서 반응성이 높은 수산화 라디칼이 생성된다. 양극 산화는 전력 소비가 주요 비용이며, 전류 효율과 비 에너지 소비량으로 성능을 평가한다. 작동 원리는 전극에 전압을 가하면 수산화 라디칼이 생성되고, 폐수의 전기전도도를 높이기 위해 염을 첨가할 수 있다. 성능 평가는 전류 효율과 비 에너지 소비량을 통해 이루어지며, 전류 밀도, 처리 시간, 비 에너지 소비량 간의 최적의 균형점을 찾는 것이 중요하다. 양극 산화는 다양한 전극 재료를 사용하며, 응용 분야는 수영장 소독, 산업 폐수 처리, 파일럿 플랜트 사례, 그리고 대한민국에서의 매립지 침출수 처리, 고도 정수 처리, 선박 평형수 처리, 축산 폐수 처리 등이 있다.
더 읽어볼만한 페이지
2. 장치
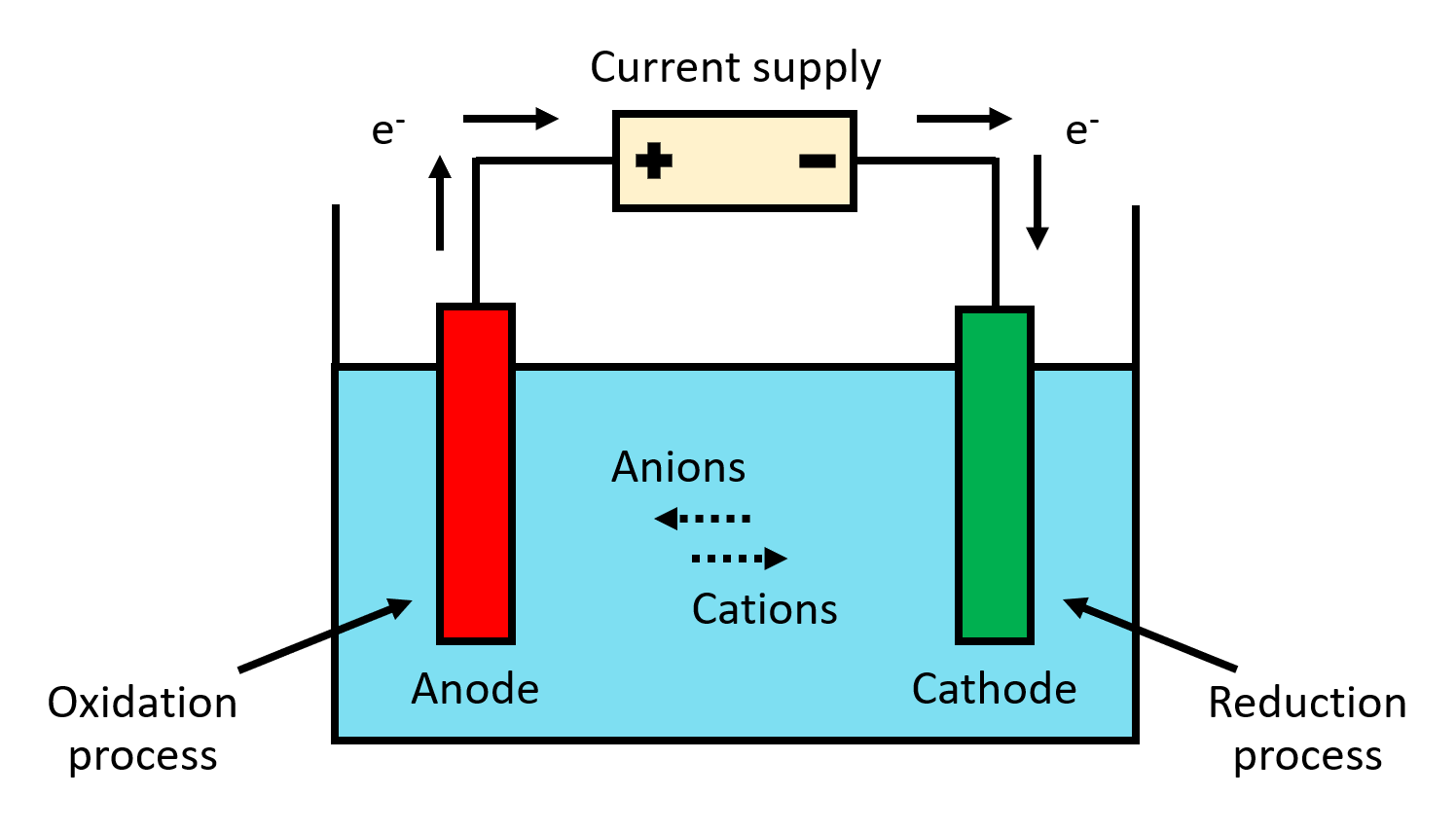
전기 산화 처리를 위한 장치는 기본적으로 전극이 담긴 전기화학 전지로 구성된다. 전극에 외부 전위차(전압)를 가하면 전극 표면 근처에서 반응성 종, 즉 수산화 라디칼이 생성된다.[11]
2. 1. 구성
양극 산화는 전기화학 전지를 이용하여 처리 대상 물질을 산화시키는 공정이다. 외부에서 전위차(전압)를 가하면 전극 표면 근처에서 반응성이 높은 수산화 라디칼이 생성된다.[11] 라디칼 생성 속도를 유지하기 위해 전압을 조절하여 10~100 mA/cm2의 전류밀도를 공급한다.[9]전극은 음극과 양극으로 구성된다. 음극은 주로 스테인리스강 판, 백금 메쉬, 탄소 펠트 전극을 사용한다.[3] 양극은 처리 대상 물질에 따라 다양한 재료가 사용된다. ( 참조)[12]
폐수의 전기전도도를 높이기 위해 염화나트륨이나 황산나트륨과 같은 염을 첨가하여 전해질로 사용한다. 염 농도는 일반적으로 리터당 몇 그램 범위이며, 염 첨가는 전력 소비를 최대 30%까지 줄일 수 있다.[14]
양극 산화 공정의 주요 비용은 전력 소비이며, 성능은 전류 효율과 비 에너지 소비량으로 평가된다.[15][16] 전류 효율은 시간에 따라 단조 감소하며,[9] 비 에너지 소비량은 용액에서 화학적 산소 요구량 단위를 제거하는 데 필요한 에너지를 측정한다.[16] 처리 용액에 따라 전류 효율이 달라지므로, 제거 효율을 충족하기 위해 전류 밀도, 처리 시간, 비 에너지 소비량 간의 최적의 절충점을 찾아야 한다.[17]
2. 2. 작동 원리
전기산화 처리를 위한 장치는 전기화학 전지로 구성된다. 외부 전위차(전압)가 전극에 인가되면 전극 표면 근처에서 반응성 종, 즉 수산화 라디칼이 생성된다.[11] 라디칼 생성 속도를 적절히 유지하기 위해 전압을 조절하여 10~100 mA/cm2의 전류밀도를 제공한다.[9] 음극은 대부분 스테인리스강 판, 백금 메쉬 또는 탄소 펠트 전극으로 만들어진다.[3]
폐수의 특성에 따라 용액의 전기전도도를 높여야 할 수 있으며,일반적으로 1000 mS/cm를 기준으로 삼는다.[13] 염화나트륨이나 황산나트륨과 같은 염을 용액에 첨가하여 전해질로 작용하게 하여 전기전도도를 높일 수 있다. 염 농도의 일반적인 값은 리터당 몇 그램 범위이지만, 첨가는 전력 소비에 상당한 영향을 미치며 최대 30%까지 줄일 수 있다.[14]
전기산화 공정과 관련된 주요 비용은 전력 소비이므로, 그 성능은 일반적으로 전류 효율과 비 에너지 소비량이라는 두 가지 주요 매개변수를 통해 평가된다.[15][16] 전류 효율은 시간에 따라 변하는 매개변수이며 처리 시간에 따라 단조 감소한다.[9]
2. 3. 성능 평가
전기 산화 공정의 성능은 주로 전류 효율과 비 에너지 소비량으로 평가된다.[15][16]전류 효율은 전기 분해 과정에서 통과된 총 전하량에 대한 특정 종의 산화에 필요한 전하량의 비율로 정의된다. 일반 전류 효율(GCE)은 전체 공정에 걸친 전류 효율 값의 평균으로, 다음과 같이 계산된다.[15]
:
여기서 COD0과 CODt는 초기 및 t 시간 후의 화학적 산소 요구량(g/dm3), F는 패러데이 상수(96,485 C/mol), V는 전해질 부피(dm3), I는 전류(A), t는 처리 시간(h), 8은 산소의 당량이다.[15] 전류 효율은 시간에 따라 감소하는 경향을 보인다.[9]
비 에너지 소비량은 용액에서 화학적 산소 요구량 단위를 제거하는 데 필요한 에너지를 의미하며, kWh/kgCOD 단위로 표현된다. 계산식은 다음과 같다.[16]
:
여기서 EC는 전지 전압(V), I는 전류(A), t는 처리 시간(h), (ΔCOD)t는 공정 종료 시 COD 감소량(g/L), Vs는 용질 부피(L)이다.[16]
전류 밀도, 처리 시간, 비 에너지 소비량 사이의 최적의 균형점을 찾는 것이 중요하며, 이는 처리 용액에 따라 달라진다.[17]
전기 산화 처리를 위한 장치는 전기화학 전지로 구성된다. 외부 전위차(전압)가 전극에 가해지면 전극 표면 근처에서 수산화 라디칼이 생성된다.[11] 라디칼 생성 속도를 유지하기 위해 전압을 조절하여 10~100 mA/cm2의 전류밀도를 제공한다.[9]
폐수 특성에 따라 전기전도도를 높이기 위해 염화나트륨이나 황산나트륨과 같은 염을 첨가할 수 있다. 염 농도는 리터당 몇 그램 수준이며, 전력 소비를 최대 30%까지 줄일 수 있다.[14]
3. 작동 원리
3. 1. 직접 산화
전극에 전압이 인가되면, 양극 근처에서 산소 발생 반응의 중간체, 특히 하이드록실 라디칼이 생성된다. 하이드록실 라디칼은 가장 높은 산화 환원 전위 중 하나를 가지는 것으로 알려져 있으며, 많은 내화성 유기 화합물을 분해할 수 있다. 양극에서 물의 산화를 통한 하이드록실 라디칼 형성에 대한 반응 메커니즘은 다음과 같다.[18]S + H2O → S[∗OH] + H+ + e-
여기서 S는 전극 표면의 흡착에 대한 일반적인 표면 자리를 나타낸다. 라디칼 종은 양극 재료에 따라 두 가지 다른 반응 메커니즘을 통해 오염 물질과 상호 작용할 수 있다.[19] "활성" 양극의 표면은 하이드록실 라디칼과 강하게 상호 작용하여 더 높은 상태의 산화물 또는 초산화물을 생성한다.[20] 고차 산화물은 유기 오염 물질의 선택적 산화에서 매개체 역할을 한다. 라디칼이 전극 표면에 강하게 화학 흡착되기 때문에, 반응은 양극 표면 근처로 제한된다.[9]
S[∗OH] → SO +H+ + e-
SO + R → S + RO
여기서 R은 일반적인 유기 화합물이고, RO는 부분적으로 산화된 생성물이다.[9]
전극이 라디칼과 약하게 상호 작용하면 "비활성" 양극으로 분류된다. 하이드록실 라디칼은 약한 상호 작용력을 통해 전극 표면에 물리 흡착되므로 오염 물질과의 반응에 이용 가능하다.[9] 유기 오염 물질은 CO2와 같은 완전히 산화된 생성물로 전환되며, 활성 양극과 비교하여 훨씬 덜 선택적인 방식으로 반응이 일어난다.[19]
S[∗OH] + R → S + mCO2 + nH2O + H+ + e-
화학 흡착 및 물리 흡착된 라디칼 모두 산소 발생 경쟁 반응을 겪을 수 있다. 활성 및 비활성 양극 간의 구분은 산소 발생 과전압에 따라 이루어진다. 백금, 흑연 또는 혼합 금속 산화물 전극의 경우와 같이 산소 과전압이 낮은 전극은 활성 거동을 보인다. 반대로, 산소 과전압이 높은 전극은 비활성이다.[11] 비활성 전극의 전형적인 예로는 이산화 납 또는 붕소 도핑 다이아몬드 전극이 있다.[9] 더 높은 산소 과전압은 산소 발생 반응의 수율이 낮음을 의미하므로 양극 공정 효율이 높아진다.[11]
3. 2. 매개 산화
적절한 산화제가 용액에 녹으면 전기화학적 산화 과정은 전극 표면뿐만 아니라 용액 내에서도 다른 산화종 형성을 촉진한다.[11] 매개 산화에 가장 널리 사용되는 종은 염화물인데, 이는 대부분의 폐수 유출수에 염화물이 매우 일반적이며 차아염소산염으로 쉽게 전환될 수 있기 때문이다.[1] 차아염소산염이 주요 생성물이지만, 염소와 차아염소산도 반응 중간체로 형성된다. 이러한 종은 많은 유기 화합물과 강하게 반응하여 광물화를 촉진하지만, 여러 가지 원하지 않는 중간체와 최종 생성물을 생성할 수도 있다.[1] 이러한 염소화 부산물은 때때로 원래의 유출물 오염 물질보다 더 해로울 수 있으며 제거하기 위해 추가적인 처리가 필요하다.[21] 이러한 문제를 피하기 위해, 염화나트륨 대신 황산나트륨을 전해질로 사용하여 매개 산화 반응에 염화물 이온이 이용되지 않도록 한다. 황산염도 매개 산화에 관여할 수 있지만, 이를 위해서는 높은 산소 발생 과전압을 가진 전극이 필요하다.[22]4. 전극 재료
4. 1. 탄소 및 흑연
탄소 또는 흑연 기반 전극은 저렴한 비용과 넓은 표면적 덕분에 널리 사용된다.[11] 이러한 전극은 오염 물질의 표면 흡착을 돕고, 전기 산화를 위한 라디칼 생성을 촉진한다.[11] 그러나 높은 전위에서는 표면 부식이 발생하여 효율이 저하되고 노출된 영역이 점차 열화되므로, 이러한 전극은 고전위 작동에 적합하지 않다.[11] 흑연의 산소 발생 과전압은 표준 수소 전극(SHE) 대비 1.7V로 매우 낮다.[23]4. 2. 백금
백금 전극은 우수한 전도성을 제공하며, 높은 전위에서도 불활성이고 안정적이다.[11] 백금은 표준수소전극(SHE) 대비 1.6V로 흑연과 비슷한 낮은 산소 발생 과전압을 갖는다.[11] 결과적으로, 백금 전극을 이용한 전기산화는 화합물의 부분적 산화로 인해 일반적으로 수율이 낮다.[12] 오염물질은 분해하기 어려운 안정적인 중간체로 전환되어 완전한 무기화에 대한 전류 효율을 감소시킨다.[12]4. 3. 혼합 금속 산화물 (MMOs)
혼합 금속 산화물(Mixed metal oxides, MMOs)은 차원 안정형 양극(dimensionally stable anodes)으로도 불리며, 염소 및 산소 발생을 효과적으로 촉진하여 전기화학 공정 산업에서 널리 사용된다.[24] 특히 염소알칼리 공정과 물 전기분해 공정에 광범위하게 사용된다. 하지만 폐수 처리에서는 산소 발생의 경쟁 반응 때문에 낮은 전류 효율을 보인다.[24] 백금 전극과 마찬가지로, 오염 물질의 완전한 무기화보다는 안정적인 중간체 형성을 선호하여 제거 효율이 떨어진다.[11]염소 발생 반응을 촉진하는 능력으로 인해, 차원 안정형 양극은 매개 산화 메커니즘에 의존하는 공정, 특히 염소 및 차아염소산염 생산에 가장 일반적으로 사용된다.[25]
4. 4. 이산화 납
이산화 납(Lead dioxide) 전극은 높은 안정성, 넓은 표면적, 우수한 전도성, 그리고 저렴한 가격 때문에 오랫동안 산업적으로 활용되어 왔다.[11] 또한, 이산화 납은 매우 높은 산소 발생 과전압(표준수소전극(Standard hydrogen electrode, SHE) 대비 1.9V)을 가지고 있어 완전한 무기화에 대한 높은 전류 효율을 의미한다.[11] 또한, 이산화 납 전극은 고전위에서 또 다른 강력한 산화제인 오존을 생성할 수 있다.[11]
적절한 결정 구조를 선택함으로써 이러한 전극의 전기화학적 특성과 안정성을 향상시킬 수 있다. 고결정성 β-상 이산화 납은 다공성 구조에 의해 활성 표면적이 증가되어 페놀 제거에서 향상된 성능을 보였다.[26] 더욱이, 박막 내에 철(Fe), 비스무트(Bi) 또는 비소(As)와 같은 금속 종을 첨가하면 무기화에 대한 전류 효율이 증가하는 것으로 밝혀졌다.[27]
4. 5. 붕소 도핑 다이아몬드 (BDD)
붕소(Boron)로 도핑된 합성 다이아몬드는 전도성을 높여 전기화학적 전극으로 사용될 수 있다. 붕소 도핑된 다이아몬드 전극(BDD)은 높은 화학적 및 전기화학적 안정성, 우수한 전도성, 가혹한 환경에서도 뛰어난 내식성, 그리고 매우 넓은 전위창(2.3V vs 표준수소전극(SHE))을 보인다.[11] 이러한 이유로 BDD는 일반적으로 유기물의 완전한 무기화에 가장 효과적인 전극으로 간주되며, 다른 모든 전극에 비해 높은 전류 효율과 낮은 에너지 소비를 제공한다.[3] 하지만 고온 화학 기상 증착(CVD) 기술을 기반으로 하는 이 전극의 제조 공정은 매우 비용이 많이 든다.[11]5. 반응 속도론
전극 표면에서 수산화 라디칼이 형성되면 유기 오염물질과 빠르게 반응하여 수 나노초의 수명을 갖게 된다.[16] 그러나 반응이 일어나려면 용액의 대부분에서 전극 표면 근처로 이온의 이동이 필요하다. 특정 전위 이상에서는 전극 근처에서 생성된 활성종이 즉시 소모되고 전극 표면 근처의 경계층을 통한 확산이 공정의 속도 제한 단계가 된다. 이것은 일부 빠른 전극 반응의 관찰된 속도가 수송 제한으로 인해 낮을 수 있는 이유를 설명한다.[28] 한계 전류 밀도 평가는 전기화학적 공정이 확산 제어되는지 여부를 평가하는 도구로 사용할 수 있다.[29]
시스템의 물질 전달 계수가 알려진 경우 일반적인 유기 오염 물질에 대한 한계 전류 밀도는 다음 관계식에 따라 정의할 수 있다.[29]
:
여기서 jL은 한계 전류 밀도(A/m2), F는 패러데이 상수(96,485 C/mol), kd는 물질 전달 계수(m/s), COD는 유기 오염 물질의 화학적 산소 요구량(g/dm3), 8은 산소의 당량 질량이다.[29]
이 방정식에 따르면 COD가 낮을수록 해당 한계 전류가 낮아진다. 따라서 COD가 낮은 시스템은 확산 제어로 작동할 가능성이 높으며, 지수 감소를 보이는 유사 일차 반응 속도론을 나타낸다. 반대로, 높은 COD 농도(약 4000 mg/L 이상)에서는 오염 물질이 운동 제어(한계값 이하의 실제 전류) 하에서 분해되며, 영차 반응 속도론에 따라 선형 추세를 따른다. 중간값의 경우 COD는 처음에는 운동 제어 하에서 선형으로 감소하지만, 임계 COD 값 이하에서는 확산이 속도 제한 단계가 되어 지수 추세가 된다.[29]
순환 전압 전류법과 같은 다른 분석 절차로 한계 전류 밀도를 얻으면 제안된 방정식을 사용하여 조사된 시스템에 대한 해당 물질 전달 계수를 검색할 수 있다.[29]
5. 1. 확산 제어 반응
전극 표면에서 수산화 라디칼이 형성되면 유기 오염물질과 빠르게 반응하여 수 나노초의 수명을 갖게 된다.[16] 그러나 반응이 일어나려면 용액의 대부분에서 전극 표면 근처로 이온의 이동이 필요하다. 특정 전위 이상에서는 전극 근처에서 생성된 활성종이 즉시 소모되고 전극 표면 근처의 경계층을 통한 확산이 공정의 속도 제한 단계가 된다. 이것은 일부 빠른 전극 반응의 관찰된 속도가 수송 제한으로 인해 낮을 수 있는 이유를 설명한다.[28] 한계 전류 밀도 평가는 전기화학적 공정이 확산 제어되는지 여부를 평가하는 도구로 사용할 수 있다.[29]시스템의 물질 전달 계수가 알려진 경우 일반적인 유기 오염 물질에 대한 한계 전류 밀도는 다음 관계식에 따라 정의할 수 있다.[29]
:
여기서 jL은 한계 전류 밀도(A/m2), F는 패러데이 상수(96,485 C/mol), kd는 물질 전달 계수(m/s), COD는 유기 오염 물질의 화학적 산소 요구량(g/dm3), 8은 산소의 당량 질량이다.[29]
이 방정식에 따르면 COD가 낮을수록 해당 한계 전류가 낮아진다. 따라서 COD가 낮은 시스템은 확산 제어로 작동할 가능성이 높으며, 지수 감소를 보이는 유사 일차 반응 속도론을 나타낸다.[29] 순환 전압 전류법과 같은 다른 분석 절차로 한계 전류 밀도를 얻으면 제안된 방정식을 사용하여 조사된 시스템에 대한 해당 물질 전달 계수를 검색할 수 있다.[29]
5. 2. 운동 제어 반응
높은 COD 농도(약 4000 mg/L 이상)에서는 운동 제어 하에서 오염 물질이 영차 반응 속도론에 따라 선형적으로 분해된다.[29] 전극 표면에서 수산화 라디칼이 형성되면 유기 오염물질과 빠르게 반응하여 수 나노초의 수명을 갖는다.[16] 그러나 반응이 일어나려면 용액의 대부분에서 전극 표면 근처로 이온의 이동이 필요하다. 특정 전위 이상에서는 전극 근처에서 생성된 활성종이 즉시 소모되고 전극 표면 근처의 경계층을 통한 확산이 공정의 속도 제한 단계가 된다. 이것은 일부 빠른 전극 반응의 관찰된 속도가 수송 제한으로 인해 낮을 수 있는 이유를 설명한다.[28]5. 3. 중간 COD
전극 표면에서 수산화 라디칼이 형성되면 유기 오염물질과 빠르게 반응하지만, 반응이 일어나려면 용액의 대부분에서 전극 표면 근처로 이온의 이동이 필요하다.[16] 특정 전위 이상에서는 전극 근처에서 생성된 활성종이 즉시 소모되고 전극 표면 근처의 경계층을 통한 확산이 공정의 속도 제한 단계가 된다.[28] 한계 전류 밀도 평가는 전기화학적 공정이 확산 제어되는지 여부를 평가하는 도구로 사용될 수 있다.[29]일반적인 유기 오염 물질에 대한 한계 전류 밀도는 다음 관계식에 따라 정의할 수 있다.[29]
:
여기서 jL은 한계 전류 밀도(A/m2), F는 패러데이 상수(96,485 C/mol), kd는 물질 전달 계수(m/s), COD는 유기 오염 물질의 화학적 산소 요구량(g/dm3), 8은 산소의 당량 질량이다.[29]
이 방정식에 따르면 COD가 낮을수록 해당 한계 전류가 낮아진다. 중간값의 경우 COD는 처음에는 운동 제어 하에서 선형으로 감소하지만, 임계 COD 값 이하에서는 확산이 속도 제한 단계가 되어 지수 추세가 된다.[29]
6. 응용 분야
철저한 공정 설계 및 전극 제형 연구를 거쳐 전기산화는 이미 파일럿 규모 시설과 상업적으로 이용 가능한 완전 규모 설비 모두에 적용되었다.[1] 관련 사례는 다음과 같다.
- Oxineo와 Sysneo는 공공 및 개인 수영장 소독을 위한 전용 제품으로, 물속의 미생물을 파괴하기 위해 BDD 전극을 이용한 전기산화를 통해 라디칼을 생성한다.[1] 이러한 시스템은 화학 약품 투입이 필요 없고 염소 냄새가 나지 않으며 조류 형성과 축적을 방지한다.[1]
- CONDIAS와 Advanced Diamond Technologies Inc.는 CONDIACELL과 Diamonox 상표로 BDD 전극을 이용한 양극 산화 장비를 공급하며, 이는 수처리 또는 산업 폐수 처리에 사용될 수 있다.[1]
- 2007년 스페인 칸타브리아에는 호기성 처리 및 화학적 펜톤 산화 후 최종 단계로 BDD 전극을 이용한 전기산화를 적용한 파일럿 플랜트가 설치되었는데, 결합된 공정의 유기 오염 물질 제거 효율은 99%였다.[30]
6. 1. 수영장 소독
Oxineo와 Sysneo는 공공 및 개인 수영장 소독을 위한 전용 제품으로, 물속의 미생물을 파괴하기 위해 BDD 전극을 이용한 전기산화를 통해 라디칼을 생성한다.[1] 이러한 시스템은 화학 약품 투입이 필요 없고 염소 냄새가 나지 않으며 조류 형성과 축적을 방지한다.[1]6. 2. 산업 폐수 처리
CONDIAS와 Advanced Diamond Technologies Inc.는 CONDIACELL과 Diamonox 상표로 BDD 전극을 이용한 양극 산화 장비를 공급하며, 이는 수처리 또는 산업 폐수 처리에 사용될 수 있다.[1] 2007년 스페인 칸타브리아에는 호기성 처리 및 화학적 펜톤 산화 후 최종 단계로 BDD 전극을 이용한 전기산화를 적용한 파일럿 플랜트가 설치되었는데, 결합된 공정의 유기 오염 물질 제거 효율은 99%였다.[30]6. 3. 파일럿 플랜트 사례
2007년 스페인 칸타브리아에 설치된 파일럿 플랜트는 호기성 처리 및 화학적 펜톤(Fenton) 산화 후 최종 단계로 BDD 전극을 이용한 전기산화를 적용하였다.[30] 결합된 공정의 유기 오염 물질 제거 효율은 99%였다.[30]6. 4. 기타 응용 분야 (대한민국)
전기 산화 기술은 대한민국에서도 다양한 분야에 응용되고 있다.[1]- 매립지 침출수 처리: 난분해성 유기물, 중금속, 암모니아성 질소 등 복합 오염 물질을 효과적으로 처리한다.
- 고도 정수 처리: 미량 유해 물질을 제거하고 소독 부산물 생성을 억제하는 데 활용된다.
- 선박 평형수 처리: 외래 생물종 제거를 위한 친환경 처리 기술로 주목받고 있다.
- 축산 폐수 처리: 고농도 유기물, 질소, 인 등을 효과적으로 제거하여 수질 오염을 방지한다.
스페인 칸타브리아에서는 2007년에 파일럿 플랜트가 설치되어, 호기성 처리 및 화학적 펜톤(Fenton) 산화 후 최종 단계로 BDD 전극을 이용한 전기산화가 적용되었으며, 결합된 공정의 유기 오염 물질 제거 효율은 99%였다.[30]
7. 참고 문헌
wikitext
참조
[1]
저널
Electrochemical advanced oxidation processes: today and tomorrow. A review
2014
[2]
저널
Contributions of electrochemical oxidation to waste-water treatment: fundamentals and review of applications
2009
[3]
저널
Recent developments of electro-oxidation in water treatment — A review
2015
[4]
저널
Conductive-diamond electrochemical oxidation of chlorpyrifos in wastewater and identification of its main degradation products by LC–TOFMS
2012
[5]
저널
Mineralization of paracetamol in aqueous medium by anodic oxidation with a boron-doped diamond electrode
2005
[6]
저널
Anodic oxidation process for the degradation of 2, 4-dichlorophenol in aqueous solution and the enhancement of biodegradability
2010
[7]
저널
Influence of the boron doping level on the electrochemical oxidation of the azo dyes at Si/BDD thin film electrodes
2013
[8]
저널
Electrochemical oxidation of methyl orange azo dye at pilot flow plant using BDD technology
2013
[9]
저널
Electrochemical advanced oxidation and biological processes for wastewater treatment: a review of the combined approaches
2014
[10]
저널
Importance of Combined Electrochemical Process Sequence and Electrode Arrangements: A Lab-scale Trial of Real Reverse Osmosis Landfill Leachate Concentrate
'2021-03'
[11]
저널
Direct And Mediated Anodic Oxidation of Organic Pollutants
2009
[12]
저널
Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for waste water treatment
1994
[13]
저널
Improving biodegradability of soil washing effluents using anodic oxidation
2018
[14]
저널
Treatment of Fenton-refractory olive oil mill wastes by electrochemical oxidation with boron-doped diamond anodes
2006
[15]
저널
Electrochemical Oxidation of 4-Chlorophenol for Wastewater Treatment: Definition of Normalized Current Efficiency (φ)
2001
[16]
저널
Combination of anodic oxidation and biological treatment for the removal of phenanthrene and Tween 80 from soil washing solution
2016
[17]
저널
Anodic oxidation of 1,4-dioxane on boron-doped diamond electrodes for wastewater treatment
2010
[18]
저널
Electrocatalysis of Anodic Oxygen-Transfer Reactions
1994
[19]
저널
Removal of the Pesticide Methamidophos from Aqueous Solutions by Electrooxidation using Pb/PbO 2 , Ti/SnO 2 , and Si/BDD Electrodes
2008
[20]
저널
Theoretical model for the anodic oxidation of organics on metal oxide electrodes
1997
[21]
저널
Electrochemical oxidation of several chlorophenols on diamond electrodes Part I. Reaction mechanism
2003
[22]
저널
Electroassisted methods for waste destruction: Silver(II) and peroxydisulfate reagents in the electrochemically mediated oxidation of polyaromatic sulfonates
2004
[23]
저널
Electrochemical degradation of aqueous solution of Amaranth azo dye on ACF under potentiostatic model
2008
[24]
웹사이트
Highly robust and efficient Ti-based Sb-SnO2 anode with a mixed carbon and nitrogen interlayer for electrochemical 1,4-dioxane removal from water
https://www.scienced[...]
[25]
저널
Anodic oxidation of phenol in the presence of NaCl for wastewater treatment
1995
[26]
저널
Electrochemical oxidation of trans-3,4-dihydroxycinnamic acid at PbO2 electrodes: direct electrolysis and ozone mediated reactions compared
2000
[27]
저널
Electrocatalysis of Anodic Oxygen-Transfer Reactions
1990
[28]
저널
Mixing and the Selectivity of Chemical Reactions
2003
[29]
저널
Degradation of mixtures of phenols using boron doped diamond electrodes for wastewater treatment
2004
[30]
저널
Integrated treatment of landfill leachates including electrooxidation at pilot plant scale
2009
[31]
저널
Electrochemical advanced oxidation processes: today and tomorrow. A review
2014
[32]
저널
Contributions of electrochemical oxidation to waste-water treatment: fundamentals and review of applications
2009
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com